Kết quả: kỹ thuật FISH sau khi hoàn thiện đã chẩn đoán được 50 phôi; trong đó 21 phôi có lệch bội. Kết luận: đã hoàn thiện và áp dụng được quy trình phát hiện bất thường NST trước chuyển phôi trên các phôi TTTON.
ĐẶT VẤN ĐỀ
Hiện nay, tỷ lệ vô sinh chiếm khoảng 5 - 10% các cặp vợ chồng trong độ tuổi sinh sản. Cùng với sự phát triển của khoa học, kỹ thuật TTTON (In Vitro Fertilization - IVF) đóng vai trò quan trọng trong lĩnh vực hỗ trợ sinh sản và ngày càng phát triển rộng khắp nơi trên thế giới. Tuy nhiên, trong nhiều trường hợp, nguyên nhân khiến người phụ nữ không có thai sau khi được chuyển phôi là do phôi có bất thường về số lượng NST như vô nhiễm, đơn nhiễm, tam nhiễm... Hiện tượng lệch bội NST ở phôi người trong quá trình điều trị bằng TTTON đã được nêu ra từ lâu và nhiều nghiên cứu cũng công nhận hiện tượng này xảy ra ở giai đoạn trước khi làm tổ.
Vì vậy, trước khi cấy chuyển phôi bào cần chẩn đoán bất thường NST. PGD (Pre-implantation Genetic Diagnosis) là quá trình chẩn đoán di truyền trước làm tổ, kỹ thuật này giúp cho việc có thể chọn được tương đối chính xác những phôi không có bất thường về di truyền để cấy vào tử cung người mẹ. Từ đó, nâng cao tỷ lệ thành công của kỹ thuật TTTON, giúp cho ra đời các em bé khỏe mạnh. Vì vậy, chúng tôi tiến hành nghiên cứu này nhằm: Hoàn thiện quy trình phát hiện bất thường NST trước chuyển phôi bằng kỹ thuật FISH.
ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
1. Đối tượng nghiên cứu.
50 tế bào (TB) phôi được sinh thiết từ các phôi dư (lưu trữ tại Trung tâm Công nghệ Phôi, Học viện Quân y).
- Hóa chất kỹ thuật FISH:
Sử dụng bộ kít Vysis MultiVysion PGT: có đầu dò đối với các NST 13, 18, 21, X và Y. Dung dịch nhược trương (1% Na citrate và 6 mg/ml HSA); dung dịch cố định (Carnoy 3:1); methanol 100%; dung dịch 0,4X SSC/0,3% NP40; 2X SSC/0,1% NP40; antiface II; cement (chất gắn lamen).
- Thiết bị: kính hiển vi soi nổi, buồng lai, tủ ổn nhiệt, bể ổn nhiệt, kính hiển vi huỳnh quang.
2. Phương pháp nghiên cứu.
* Quy trình thụ tinh bằng phương pháp ICSI và quy trình sinh thiết TB phôi:
Quy trình thụ tinh bằng phương pháp ICSI và quy trình sinh thiết các TB phôi ngày được tiến hành tại Trung tâm Công nghệ Phôi, Học viện Quân y. TB phôi sau khi sinh thiết được đặt lên đĩa sinh thiết, bảo quản trong các giọt dầu và chuyển sang Trung tâm Nghiên cứu Y Dược học Quân sự, Học viện Quân y để tiến hành thực hiện kỹ thuật FISH.
* Quy trình FISH:
- Công đoạn cố định TB lên lam kính: chuẩn bị đĩa petri có nhỏ sẵn các giọt dung dịch. Quan sát dưới kính hiển vi soi nổi, hút một TB phôi, sau đó đặt vào giọt thứ nhất (giọt dung dịch PBS) để rửa sạch dầu (lớp dầu bảo quản TB phôi). Sau đó, hút chuyển các TB sang giọt thứ hai (dung dịch nhược trương). Ở giọt thứ hai, sau khoảng 5 phút, hút TB và đặt lên lam kính. Khi thấy vị trí có TB gần khô hoàn toàn, tiến hành nhỏ lần lượt từng giọt dung dịch cố định lên vòng tròn đã khoanh, mỗi giọt khoảng 2 µl. Giọt trước khô mới tiếp tục nhỏ giọt tiếp theo. Khi thấy hình ảnh nhân TB rõ ràng thì dừng việc nhỏ dung dịch cố định. Để tiêu bản khô ở nhiệt độ phòng.
- Công đoạn lai đầu dò với TB bạch cầu và TB phôi: ngâm tiêu bản vào methanol trong 2 phút. Sau đó lấy ra để tiêu bản khô ở nhiệt độ phòng. Lấy mẫu dò ADN MultiVysion PGT từ tủ bảo quản -200C để ở nhiệt độ phòng trước khi sử dụng từ 5 - 10 phút. Nhỏ 3 µl mẫu dò lên vùng lai có chứa TB đã được đánh dấu. Đặt nhẹ nhàng lamen phủ lên vùng lai. Gắn rubber cement quanh vị trí mép lamen để tránh bay hơi dung dịch mẫu dò trong quá trình lai. Đặt lam mẫu vào buồng lai. Đặt chương trình: 730C trong 10 phút, 370C trong 3 giờ.
- Công đoạn rửa tiêu bản sau lai: lấy tiêu bản ra khỏi buồng lai, nhẹ nhàng gỡ bỏ rubber cement và lamen. Nhúng tiêu bản vào cốc đựng dung dịch 0,4X SSC/0,3% NP40 trong 2 phút. Dung dịch này phải đạt được 730C từ trước khi sử dụng. Sau đó, lấy tiêu bản ra, nhúng tiếp vào cốc đựng dung dịch 2X SSC/0,1% NP40 ở nhiệt độ phòng trong 1 phút. Lấy tiêu bản ra để khô hoàn toàn trong tủ ấm 370C (tránh ánh sáng).
- Công đoạn phân tích tín hiệu sau lai: sau khi lam khô, nhỏ 3 µl antifade II lên vùng lai và đậy lamen kính lên trên. Quan sát phân tích tín hiệu lai dưới kính hiển vi huỳnh quang với từng phin lọc thích hợp, đưa ra kết luận với từng mẫu phôi bào cụ thể.
KẾT QUẢ NGHIÊN CỨU VÀ BÀN LUẬN
1. Kết quả hoàn thiện quy trình kỹ thuật FISH trên TB phôi sinh thiết từ các phôi dư.
Sử dụng kỹ thuật FISH để xác định những bất thường NST đã được thực hiện ở nhiều trung tâm nghiên cứu trên thế giới. Chúng tôi sử dụng bộ kít Vysis MultiVysion đã thương mại hóa và được nhiều trung tâm nghiên cứu trên thế giới sử dụng.
Đối với quá trình chuẩn hóa quy trình FISH, sinh thiết từ các mẫu phôi dư được tổng số 58 TB phôi (có TB phôi ngày 3 và TB phôi ngày 5).
Trước khi bước vào thực hiện kỹ thuật FISH để chuẩn hóa quy trình, tiến hành thử thao tác cố định TB lên lam kính đối với 5 TB phôi. Trong quá trình thao tác trên 5 TB phôi, 3/5 TB bị bong do nguyên nhân: lam kính sử dụng chưa đủ sạch nên TB khó bám dính vào lam, quá trình nhỏ dung dịch cố định là carnoy quá nhanh và nhiều. Sau khi rút kinh nghiệm, đã cố định được 2/5 TB phôi còn lại.
Trong quá trình thực hiện kỹ thuật, chúng tôi thấy công đoạn cố định TB lên lam kính hết sức quan trọng, cần đặc biệt chú ý tới bước nhỏ dung dịch Carnoy cố định lên vị trí có TB phôi. Nếu TB phôi bị bong khỏi lam trong quá trình thao tác thì kỹ thuật thất bại.
Các chú ý trong quá trình gắn TB lên lam kính: hút TB hết sức cẩn thận, nhẹ nhàng, tránh làm vỡ TB khi rửa trong giọt PBS 1X. Rửa sạch dung dịch dầu, nếu rửa không sạch dầu vẫn bám lên bề mặt TB phôi, do vậy không thể làm nhược trương để bộc lộ nhân TB. Khi đó, quá trình lai với các tín hiệu đầu dò sẽ thất bại. Dung dịch nhược trương phải đảm bảo được pha mới trong ngày, không quá 8 giờ trước khi sử dụng để tránh sai lệch nồng độ muối và pH. Nếu sai hỏng sẽ dẫn đến quá trình lai tín hiệu huỳnh quang không thành công.
Một chú ý nữa là khi bóc lam men ra khỏi lam kính cần bóc nhẹ nhàng, tránh làm mất TB phôi nếu TB phôi dính vào lamen. Keo gắn lamen phải đúng hang, sau khi gắn dễ dàng bóc ra sau lai, dung dịch lai không bị bay hơi sau khi ủ trong buồng lai.
Trong quá trình tiến hành kỹ thuật FISH để chuẩn hóa quy trình trên 53/58 TB phôi sinh thiết từ các phôi dư, có 3/50 TB phôi không đưa ra được kết luận có hay không có lệch bội NST do tín hiệu lai xấu; còn lại 50/58 TB phôi có tín hiệu huỳnh quang phân tích được, kết quả FISH như sau: bình thường: 29 TB (58%); bất thường: 21 TB (42%).
Đối với 50 mẫu TB phôi thu được kết quả lai, 21 mẫu cho tín hiệu bất thường ở các cặp NST 13, 18, 21, X, Y. Như vậy, tỷ lệ lệch bội NST cao, chiếm tới 42% tổng số phôi được chẩn đoán. Còn lại 29 mẫu phôi cho kết quả chẩn đoán bình thường với các cặp NST đang đánh giá chiếm 58%.
Nghiên cứu của Munné và CS (2007) thực hiện trên 6.000 phôi, kết quả: 56% BN nữ < 35 tuổi với phôi có hình thái tốt ở giai đoạn phân chia có tỷ lệ bất thường về NST, tỷ lệ này tăng theo độ tuổi người mẹ [6].
Nghiên cứu của Rubio và CS (2013) sử dụng kỹ thuật FISH 9 đầu dò 13, 15, 16, 17, 18, 21, 22 và XY nghiên cứu trên 265 phôi ngày 3 của 91 phụ nữ không có phôi làm tổ liên tiếp (tuổi trung bình 35,2), kết quả: tỷ lệ lệch bội NST là 57,3% [5].
Nguyễn Thị Hương và CS nghiên cứu 127 phôi ngày 3 bằng kỹ thuật FISH 5 đầu dò, kết quả: tỷ lệ lệch bội NST là 46,4% [1].
Như vậy, kết quả về tỷ lệ lệch bội của chúng tôi khác với một số tác giả khác, do khác về việc chọn mẫu nghiên cứu, số lượng mẫu và số lượng NST được đánh giá trong mỗi nghiên cứu.
Bảng 1: Các dạng bất thường thu được sau khi phân tích kết quả lai.
|
Hội chứng
|
Số lượng
|
Tỷ lệ %
|
|
Patau
|
4
|
19,0
|
|
Edwards
|
2
|
9,5
|
|
Down
|
7
|
33,3
|
|
Turner
|
1
|
4,8
|
|
Klinefelter
|
1
|
4,8
|
|
Bất thường khác
|
6
|
28,6
|
|
Tổng số
|
21
|
100
|
Kết quả phân tích trên 50 TB phôi: tỷ lệ phôi cho kết quả trisomy 21 cao nhất (33,3%), tiếp đến là tỷ lệ phôi trisomy 13 (19%), NST 18 và NST giới tính ít gặp bất thường.
Kết quả của chúng tôi tương đồng với nghiên cứu của Munné, Sandalinas và Cohen thực hiện trên 1.600 phôi: hầu hết dị bội NST xuất hiện ở các cặp NST 21, 22, 16, 15; trong khi các cặp NST giới tính 13, 18 ít gặp hơn [6].
Kết quả nghiên cứu cho thấy, tỷ lệ lệch bội NST trên phôi bào khá cao ở các cặp NST 13, 18, 21, X, Y. Do vậy, cần sàng lọc những bất thường này trước chuyển phôi nhằm hạn chế trẻ sinh ra mang dị tật bẩm sinh, đặc biệt là nhóm có nguy cơ cao.
Chúng tôi thu được một số hình ảnh lai như sau:
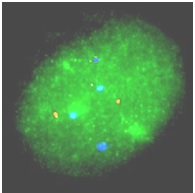
(a)
(b)
Hình 1: Kết quả FISH của các phôi bào E8 và E30 không có bất thường ở cặp NST 13, 18, 21 và cặp NST giới tính. (a) Phôi E8 có cặp NST giới tính XX; (b) Phôi E30 có cặp NST giới tính XY.
Phân tích dưới kính hiển vi huỳnh quang thấy: 2 tín hiệu màu đỏ (red) ứng với 2 NST 13, 2 tín hiệu màu xanh lá cây (green) ứng với 2 NST 21, 2 tín hiệu màu xanh lơ (aqua) ứng với 2 NST 18. Bên cạnh đó, tín hiệu màu xanh da trời (blue) ứng với NST X và tín hiệu màu vàng (gold) ứng với NST Y. Như vậy, với phôi (a) cặp NST giới tính là XX vì có 2 tín hiệu màu xanh da trời (blue), phôi (b) cặp NST giới tính là XY vì có 1 tín hiệu màu xanh da trời (blue) và 1 tín hiệu màu vàng (gold). Như vậy, với các phôi bào có số lượng tín hiệu thu được giống như trên, kết quả chẩn đoán đưa ra sau khi tiến hành kỹ thuật FISH là phôi bào không có bất thường về số lượng các cặp NST 13, 18, 21, X, Y.
Sau khi chính thức đưa quy trình FISH đã chuẩn hóa vào chẩn đoán tiền làm tổ ở phôi của BN thực hiện IVF, những phôi được chẩn đoán bằng FISH có kết quả bình thường, sẽ được cấy chuyển vào tử cung người mẹ. Điều đó giúp tăng khả năng mang thai của bà mẹ và trẻ sinh ra được khỏe mạnh.
Trong các phôi bào chúng tôi phân tích bằng kỹ thuật FISH, ngoài những phôi bào có kết quả bình thường đối với cặp NST 13, 18, 21, X, Y, chúng tôi còn thu được một số hình ảnh phôi bất thường như sau:
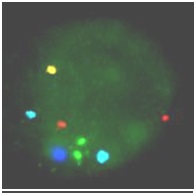
Hình 2: Kết quả FISH phôi bào E2 mang 3 NST ở các cặp NST 13, 18, 21 và NST giới tính X.

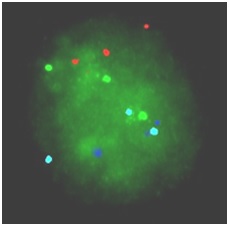
Hình 3: Kết quả FISH của phôi bào E38 mang 3 NST số 21.
Quan sát phân tích thấy phôi bào ở hình 2 có 3 tín hiệu màu đỏ (red), 3 tín hiệu màu xanh lá cây (green), 3 tín hiệu màu xanh lơ (aqua) và 3 tín hiệu với màu xanh da trời (blue). Như vậy, TB phôi này có 3 NST 13, 3 NST 18, 3 NST 21 và cặp NST giới tính là XXX.
TB phôi trên hình 3 có 2 tín hiệu màu xanh lơ, 2 tín hiệu màu đỏ, 2 tín hiệu màu xanh da trời và 3 tín hiệu màu xanh lá cây. Như vậy, phôi bào có bất thường ở NST 21, có tới 3 NST 21. Trẻ sinh ra sẽ mắc hội chứng Down.

Hình 4: Kết quả FISH của phôi bào E24 mang 3 NST số 13.
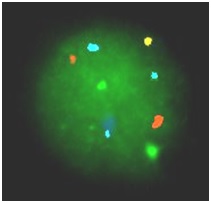
Hình 5: Kết quả FISH của phôi bào E18 mang 3 NST 18
TB phôi ở hình 4 ngoài 2 tín hiệu màu xanh lá cây, 2 tín hiệu màu xanh lơ, 1 tín hiệu màu xanh da trời, 1 tín hiệu màu vàng và 3 tín hiệu màu đỏ. Chứng tỏ phôi bào này có bất thường vì có tới 3 NST 13. Trẻ sinh ra sẽ mắc hội chứng Patau.
Trong hình ảnh lai của TB phôi trên hình 5, ngoài 2 tín hiệu màu xanh lá cây, 2 tín hiệu màu đỏ, 1 tín hiệu màu xanh da trời và 1 tín hiệu màu vàng có tới 3 tín hiệu màu xanh lơ. Chứng tỏ phôi bào này có tới 3 NST 18. Trẻ sinh ra sẽ mắc hội chứng Edwards.
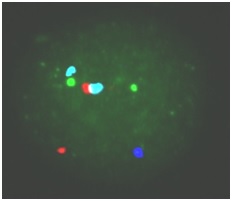
Hình 6: Kết quả FISH của phôi bào E40 mang cặp NST giới tính XO

Hình 7: Kết quả FISH của phôi bào E48 mang cặp NST giới tính XXY
TB phôi ở hình 6 thu được tín hiệu lai gồm: 2 tín hiệu màu xanh lá cây, 2 tín hiệu màu đỏ, 2 tín hiệu màu xanh lơ, 1 tín hiệu màu xanh da trời. Chứng tỏ phôi bào này có cặp NST giới tính là XO. Trẻ sinh ra sẽ mắc hội chứng Turner.
Phôi bào ở hình 7 cho kết quả lai có 2 tín hiệu với màu xanh lá cây, đỏ, xanh lơ, xanh da trời và 1 tín hiệu với màu vàng. Chứng tỏ có cặp NST giới tính là XXY. Trẻ sinh ra sẽ mắc hội chứng Klinefelter.
KẾT LUẬN
Đã chuẩn hóa được quy trình kỹ thuật FISH đối với TB phôi dư ở người nhằm chẩn đoán lệch bội NST ở các cặp NST số 13, 18, 21, X và Y. Quy trình gồm 4 bước với những thao tác đã được chuẩn hóa bảo đảm phù hợp với điều kiện phòng thí nghiệm, cho kết quả có độ chính xác cao.
Áp dụng quy trình đã hoàn thiện trên 50 mẫu TB phôi cho thấy, tỷ lệ lệch bội NST cao chiếm tới 21/50 (42%) tổng số phôi được chẩn đoán. Do vậy, cần sàng lọc các bất thường này trước chuyển phôi nhằm hạn chế trẻ sinh ra mang dị tật bẩm sinh, đặc biệt là nhóm có nguy cơ cao.
KHUYẾN NGHỊ
Trên thực tế, do kỹ thuật FISH còn có hạn chế là chỉ đánh giá được một số NST nhất định. Vì vậy, để có được kết quả chẩn đoán di truyền toàn diện nhất đối với các phôi trước khi cấy chuyển, cần kết hợp kỹ thuật FISH với những kỹ thuật chẩn đoán khác, phù hợp với từng trường hợp cụ thể.
TÀI LIỆU THAM KHẢO
1. Hoàng Thị Hương, Nguyễn Viết Tiến, Đặng Thu Hằng. Ứng dụng kỹ thuật FISH trong sàng lọc một số bệnh lệch bội NST cho chẩn đoán di truyền tiền làm tổ. Tạp chí Phụ sản. 2014, 12, tr.176-178.
2. Blancato JK. Fluorescence in situ hybridization. The Principles of clinical cytogenetics. Humana Press, New Jersey. 1999, pp.443-471.
3. Griffin DK. Dual fluorescent in situ hybridization for simultaneous detection of X and Y chromosome-specific probes for the sexing of human preimplatation embryonic cuclei. Human Genetic. 1992, 89, pp.18-22.
4. Lim HJ et al. Amniotic fluid interphase fluorescence in situ hybrization (FISH) for detection of aneuploidy; Experiences in 130 prenatal cases. J Korean Med Sci. 2002, 17, pp.89-92.
5. Rubio C, Bellver J, Rodrigo L et al. Preimplantation genetic screening using fluorescence in situ hybridization in patients with repetitive implantation failure and advanced maternal age: two randomized trials. Fertility and Sterility. 2013, 99, pp.1400-1407.
6. Munne, Sandalinas M, Cohen J. Chromosome abnormalities in human embryos. In textbook of Assited Reprodutive Techniques Laboratory and Clinical Perspectives (Eds) Gardner DK, Weissman A, Howles CM and Shoham Z. 2001, pp.297-318.
Triệu Tiến Sang*; Trần Văn Khoa*; Nguyễn Thị Việt Hà*; Nguyễn Đình Tảo*; Đỗ Minh Trung*; Đỗ Ngọc Ánh*.
* Học viện Quân y